Il tumore tenosinoviale a cellule giganti è una rara forma di neoplasia. In genere non è metastatica, ma può essere localmente aggressiva: colpisce le membrane sinoviali, le borse e le guaine tendinee, provocando gonfiore, dolore, rigidità e ridotta mobilità in corrispondenza dell’articolazione interessata. La terapia per il TGCT prevede prima un intervento chirurgico per l’asportazione del tumore. Tuttavia, nei pazienti affetti da forme recidivanti, difficili da trattare o diffuse, in cui il tumore può avvolgere l’osso, i tendini, i legamenti ed altre componenti dell’articolazione, diventa più complicato rimuoverlo o ridurlo con interventi di resezione chirurgica. Nei casi più gravi, più interventi di resezione e artroplastica possono portare a danni significativi all’articolazione, disabilità funzionali invalidanti e ridotta qualità di vita, finanche all’amputazione.
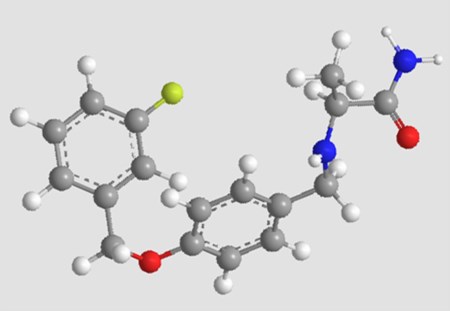
L’Agenzia Europea del Farmaco (EMA) ha convalidato la domanda di autorizzazione all’immissione in commercio (MAA) di una nuova molecola (il pexidartinib) per il trattamento di pazienti adulti con tumore tenosinoviale a cellule giganti (TGCT) sintomatico, con grave morbilità o limitazioni funzionali non suscettibile di miglioramento con la chirurgia. Il 31 gennaio 2019, la Società Americana di Oncologia Clinica (ASCO) ha riconosciuto quale “Progresso dell’anno” l’evoluzione nel trattamento dei tumori rari, e ha inserito la molecola tra le cinque più significative innovazioni nel trattamento delle malattie rare, riconoscendolo come la prima promettente terapia sperimentale per il TGCT, chiamato anche sinovite villonodulare pigmentosa (PVNS) o tumore a cellule giganti della guaina tendinea (GCT-TS).
La convalida dà inizio al processo di valutazione scientifica da parte del Comitato europeo per i medicinali ad uso umano (CHMP). La domanda all’EMA è basata sui risultati dello studio cardine di fase III ENLIVEN su pexidartinib, il primo studio controllato verso placebo di una terapia sperimentale sistemica in pazienti con TGCT, che ha raggiunto il suo endpoint primario di risposta globale. I risultati dello studio di fase III ENLIVEN sono stati presentati al Meeting annuale dell’American Society of Clinical Oncology (ASCO) del 2018.
“Siamo entusiasti del potenziale di pexidartinib, un’altra terapia mirata scoperta da Plexxikon – ha dichiarato Gideon Bollag, Ph.D., Amministratore delegato di Plexxikon Inc., centro di R&S sulle “small molecules” di Daiichi Sankyo a Berkeley, in California –Il nostro processo di scoperta dei farmaci utilizza dati sulla struttura molecolare ed una biblioteca specializzata per lo screening, con struttura simile ad un’impalcatura per identificare e ottimizzare nuove molecole candidate”.
La New Drug Application (NDA) per pexidartinib è attualmente in fase di Valutazione Prioritaria negli Stati Uniti, e la FDA dovrebbe prendere una decisione in merito all’approvazione entro il 3 agosto 2019.